Réz(II)-nitrát
A Réz(II)-nitrát világában mindig is nagy volt az érdeklődés és a kíváncsiság, hogy többet megtudjanak erről a témáról. Akár a társadalomra gyakorolt hatása, akár történelmi jelentősége, akár az élet különböző aspektusaira gyakorolt hatása miatt, a Réz(II)-nitrát továbbra is olyan téma, amely minden korosztály és hátterű ember érdeklődését felkelti. Az idő múlásával számos vizsgálat, vita és vita alakult ki a Réz(II)-nitrát körül, ami hozzájárult ahhoz, hogy különböző területeken állandó jelentőséggel bírjon. Ebben a cikkben alaposan megvizsgáljuk a Réz(II)-nitrát témáját, elemezve annak különböző aspektusait, és teljes és gazdagító víziót kínálunk erről a lenyűgöző témáról.
| Réz(II)-nitrát | |
| |

| |
| IUPAC-név | Réz(II)-nitrát |
| Kémiai azonosítók | |
|---|---|
| CAS-szám | 3251-23-8 |
| PubChem | 18616 |
| ChemSpider | 17582 |
| EINECS-szám | 221-838-5 |
| ChEBI | 78036 |
| RTECS szám | GL7875000 |
| InChIKey | XTVVROIMIGLXTD-UHFFFAOYSA-N |
| Beilstein | 4549386 |
| UNII | 9TC879S2ZV |
| UN-szám | 1477 |
| Kémiai és fizikai tulajdonságok | |
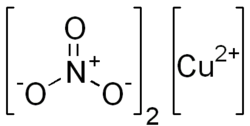
| Kémiai képlet | Cu(NO3)2 |
| Moláris tömeg | 187,57 g/mol (anhidrát), 241,60 (Cu(NO3)2.3H2O), 232,59 (Cu(NO3)2.2,5H2O) |
| Megjelenés | kék kristályok |
| Sűrűség | 2,32 g/cm³ (anhidrát) |
| Olvadáspont | 114,5 °C (trihidrát) 210 °C-on szublimál (anhidrát) |
| Forráspont | 170 °C (bomlik) |
| Oldhatóság (vízben) | 138 g/100 mL (0 °C) trihidrát |
| Veszélyek | |
| MSDS | Cu(NO3)2.3H2O |
| EU osztályozás | Oxidáló (O) Ártalmas (Xn)[1] |
| NFPA 704 | |
| R mondatok | R8, R22, R36/38[1] |
| S mondatok | S17, S24/25[1] |
| LD50 | 794 mg/kg (anhidrát, patkány, szájon át) 940 mg/kg (trihidrát, patkány, szájon át)[1] |
| Rokon vegyületek | |
| Azonos kation | CuSO4, CuCl, CuCl2, Cu2O, CuO, CuCO3 |
| Azonos anion | Nikkel(II)-nitrát Cink-nitrát |
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |
A réz(II)-nitrát egy szervetlen vegyület, a réz salétromsavas sója. Összegképlete Cu(NO3)2. A kristályvízmentes (anhidrát) változata fehér színű, a különböző hidrátjai kékek. Vízben igen jól oldódik. A vizes oldatából 25 °C fölött a trihidrátja, ez alatt a hexahidrátja kristályosodik ki. Oldható metanolban és etanolban is.
Kémiai tulajdonságai
A réz(II)-nitrát erős oxidálószer. Az oldatával átitatott papír könnyen meggyullad. Az ónt ón-dioxiddá oxidálja. Ammóniával komplex vegyületeket, amminokat képez. Ezek 2-7 mól ammóniát tartalmazhatnak. Ezek közül a hexaammin a legstabilabb, ennek vizes oldata sötétkék színű.
Előfordulása a természetben
A természetben a bázisos réz(II)-nitrát megtalálható ritka ásványként, melynek neve gerhardit.
Előállítása
Réz és salétromsav reakciójával:
- Híg salétromsavban:
- 3 Cu + 8 HNO3 → 2 NO + 4 H2O + 3 Cu(NO3)2
- Tömény salétromsavban:
- Cu + 4 HNO3 → Cu(NO3)2 + 2 NO2 + 2 H2O
Felhasználása
Más rézvegyületek (pl. réz-oxid) előállítására használják. Alkalmazzák a galvanotechnikában is. Felhasználják még fa pácolására, réz feketére színezésére, illetve tűzijátékok készítésére is.
Jegyzetek
Források
- Erdey-Grúz Tibor: Vegyszerismeret
