Alumínium-klorid
A következő cikkben a Alumínium-klorid témáját járjuk körül, amely az idők során különböző területeken érdeklődés és vita tárgyát képezte. A Alumínium-klorid eredetétől napjaink relevanciájáig szakértők és rajongók tanulmányozásának és elemzésének tárgya volt. Ebben a cikkben megvizsgáljuk annak hatását, fejlődését és a lehetséges kihívásokat, amelyekkel a mai társadalomban szembesül. Egy multidiszciplináris megközelítésen keresztül igyekszünk megérteni a Alumínium-klorid-hez kapcsolódó különféle dimenziókat és szempontokat, átfogó jövőképet kínálva, amely gondolkodásra és vitára hív.
| Alumínium-klorid | |||
 Alumínium-klorid hexahidrát | |||
 Alumínium-triklorid dimer | |||
| |||
| IUPAC-név | Alumínium-triklorid | ||
| Kémiai azonosítók | |||
|---|---|---|---|
| CAS-szám | (vízmentes) (hexahidrát) | ||
| PubChem | 24012 | ||
| ChemSpider | 22445 | ||
| EINECS-szám | 231-208-1 | ||
| DrugBank | DB11081 | ||
| ChEBI | 30114 | ||
| RTECS szám | BD0530000 | ||
| ATC kód | D10AX01 | ||
| Gyógyszer szabadnév | aluminium chloride | ||
| Gyógyszerkönyvi név | Aluminii chloridum hexahydricum | ||
| InChIKey | VSCWAEJMTAWNJL-UHFFFAOYSA-K | ||
| Gmelin | 1876 | ||
| UNII | LIF1N9568Y | ||
| UN-szám | 3264 | ||
| Kémiai és fizikai tulajdonságok | |||
| Kémiai képlet | AlCl3 | ||
| Moláris tömeg | 133,34 g/mol (vízmentes) 241,432 g/mol (hexahidrát) | ||
| Megjelenés | Fehér vagy sárga színű, szilárd | ||
| Sűrűség | 2,44 g/cm³[1] | ||
| Olvadáspont | 180 °C-on szublimál, 262 °C-on bomlik[1] | ||
| Oldhatóság (vízben) | 43,9 g/100 ml (0 °C) 44,9 g/100 ml (10 °C) 45,8 g/100 ml (20 °C) 46,6 g/100 ml (30 °C) 47,3 g/100 ml (40 °C) 48,1 g/100 ml (60 °C) 48,6 g/100 ml (80 °C) 49 g/100 ml (100 °C) | ||
| Veszélyek | |||
| EU osztályozás | Maró (C)[2] | ||
| R mondatok | R34[2] | ||
| S mondatok | (S1/2), S7/8, S28, S45[2] | ||
| LD50 | 3450 mg/kg (patkány, szájon át)[1] | ||
| Rokon vegyületek | |||
| Azonos kation | Alumínium-fluorid Alumínium-bromid Alumínium-jodid | ||
| Azonos anion | Bór-triklorid Gallium(III)-klorid Indium(III)-klorid Tallium(III)-klorid Magnézium-klorid | ||
| Rokon Lewis-savak | Vas(III)-klorid Bór-trifluorid | ||
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |||
Az alumínium-klorid az alumínium klórral alkotott vegyülete, kloridja. Képlete AlCl3. Fehér színű kristályokat alkot. Már alacsonyabb hőmérsékleten is párolog. 180 °C-on szublimál, ezért csak nagyobb nyomáson lehet megolvasztani. Erősen higroszkópos, magába szívja a levegő nedvességét és sűrű folyadékká alakul. Jól oldódik vízben. Szerves oldószerek (például alkohol, éter, aceton) is jól oldják. Vizes oldatából a hexahidrátja (AlCl3 · 6 H2O) kristályosítható ki.
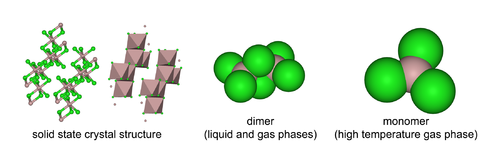
Szerkezete
Az alumínium-klorid monomer AlCl3 molekulái elektronhiányosak, ezért instabilak. Ezek a molekulák könnyen dimerizálódnak, ekkor Al2Cl6 dimer molekulák keletkeznek. Az alumínium-klorid gőzei körülbelül 700 °C hőmérsékletig tartalmaznak ilyen molekulákat, magasabb hőmérsékleten a molekulák disszociálnak. Ezek a molekulák két AlCl4 tetraéderből épülnek fel, a két tetraéder egyik éle közös. Ha a molekulák kristályrácsba rendeződnek, deformálódnak. A szilárd alumínium-klorid kristályt lazán összekapcsolódó AlCl6 oktaéderek építik fel.
Kémiai tulajdonságai
A vegyület víz hatására hidrolizál, vizes oldata savas kémhatású.
A képződő alumínium-hidroxid vízben rosszul oldódik, csapadékként válik ki. Emiatt az oldat zavaros lesz. A töményebb oldat a fejlődő hidrogén-klorid miatt füstölög. Addíciós vegyületeket képez ammóniával, kén-dioxiddal és sok szerves vegyülettel.
Előállítása
Vízmentes alumínium-kloridot úgy állítanak elő, hogy alumíniumreszeléket reagáltatnak klórral. A reakció nyersanyaga drága, ezért leginkább timföldból állítják elő szén-monoxid és klórgáz, illetve az ezekből képződő foszgén segítségével.
Timföld helyett bauxit is használható, de a bauxitból előállított alumínium-klorid gyakran vasat tartalmaz. A vegyület vizes oldatát alumínium-hidroxidból állítják elő sósavval.
Felhasználása
Szerves kémiai szintézisekben a Friedel–Crafts-reakciók katalizátora. Katalizátorként alkalmazzák műgyanták, műanyagok, gumi és kenőanyagok gyártásakor. Sok kondenzációs reakciót gyorsít. Izzadás elleni szereket is készítenek belőle.
Források
- Erdey-Grúz Tibor: Vegyszerismeret
- Nyilasi János: Szervetlen kémia



