pH
A pH (pondus hidrogenii, latinul potentia hydrogeni, hidrogénion-kitevő) dimenzió nélküli kémiai mennyiség, mely egy adott oldat kémhatását (savasságát vagy lúgosságát) jellemzi. Híg vizes oldatokban a pH egyenlő az oxóniumion-koncentráció tízes alapú logaritmusának ellentettjével.
p H = − log 10 = − lg {\displaystyle \mathrm {pH=-\log _{10}=-\lg\!} }vagy egyszerűbben:
p H = − log 10 = − lg {\displaystyle \mathrm {pH} =-\log _{10}\mathrm {} =-\lg \mathrm {} \!}(A hidrogénion (H+) a víz autoprotolízisével, vagy a savak ionizációjával keletkezik, de vizes közegben mindig hozzákapcsolódik egy vízmolekulához, és oxóniumion (H3O+) jön létre.)
A víz autoprotolízise olyan egyensúlyi reakció, melynek során 10−7 mólnyi vízmolekula ad át protont egy másiknak (1 liter vízben, 25 °C-on):
H 2 O + H 2 O ⇌ H 3 O + + O H − {\displaystyle \mathrm {H_{2}O+H_{2}O\!\rightleftharpoons H_{3}O^{+}+OH^{-}\!} }
Erre az egyensúlyi reakcióra felírható a Kvíz egyensúlyi állandó: Kvíz = = 10−7mol/dm³ · 10−7mol/dm³ = 10−14(mol/dm³)²A szögletes zárójellel a megfelelő ionok moláris koncentrációját jelöljük, ennek szokásos mértékegysége: mol/dm³; az SI-mértékegység ezerszerese. 1 dm³ = 1 liter. Ebből következik:
- tiszta vízben és semleges kémhatású oldatokban:
- = = 10−7 mol/dm³
- pH = −lg10−7 = 7
- savas közegben megnő az oxóniumionok moláris koncentrációja:
- tehát > , vagyis > 10−7 mol/dm³.
- pH < 7
- lúgos közegben lecsökken az oxóniumionok moláris koncentrációja:
- tehát < , vagyis < 10−7 mol/dm³.
- pH > 7
Összefoglalva: A tiszta víz pH-értéke 7, ennél kisebb pH-érték savasságot, nagyobb pH-érték pedig lúgosságot jelez.
Ugyanilyen gondolatmenet szerint ki lehet számítani a pOH-t is. Ennek változása ellentétes a pH változásával.
pH-értékek
| Anyag | pH-érték | savas |
|---|---|---|
| Akkumulátorsav (kénsav): H2SO4 | 0-0,5 | |
| Sósav (gyomorsav - üres gyomor) | 1,0–1,5 | |
| Citromsav | 2,4 | |
| Coca-Cola | 2,0–3,0 | |
| Ecetsav | 2,5 | |
| Gyümölcslé (meggy) | 2,7 | |
| Narancslé és almalé | 3,5 | |
| Bor | 4 | |
| Savanyú tej | 4,5 | |
| Sör | 4,5–5,0 | |
| Savas eső | < 5,0 | |
| Kávé | 5,0 | |
| Tea | 5,5 | |
| Eső | 5,6 | |
| Ásványvíz | 6,0 | |
| Tej | 6,5 | semleges |
| Víz (a víz keménységétől függően) | 6,0–8,5 | |
| Emberi nyál | 6,5–7,4 | |
| Vér | 7,4 | lúgos |
| Tengervíz | 7,5–8,4 | |
| Hasnyálmirigy-váladék (bél) | 8,3 | |
| Szappan | 9,0–10,0 | |
| Háztartási ammónia | 11,5 | |
| Oltott mész - Ca(OH)2 | 12,4 | |
| Hipó - fehérítő | 12,5 | |
| Beton | 12,6 | |
| Marónátron - NaOH | 13,5–14 |
pH-mérés
A pH értéket indikátorokkal, vagy digitális pH-mérőkkel lehet meghatározni:
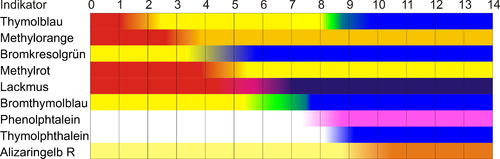 Indikátorok: timolkék, metilnarancs, brómkrezolzöld, metilvörös, lakmusz, brómtimolkék, fenolftalein, timolftalein, alizarinsárga R Indikátorok: timolkék, metilnarancs, brómkrezolzöld, metilvörös, lakmusz, brómtimolkék, fenolftalein, timolftalein, alizarinsárga R
|
 pH-indikátorok pH-indikátorok
|
 Digitális pH-mérés: 4,96-os pH-érték Digitális pH-mérés: 4,96-os pH-érték
|
 Lúgos pH Lúgos pH
|
 Igényes pH-mérés laboratóriumban Igényes pH-mérés laboratóriumban
|
Pontos definíció
A pH-ra a fenti képlet csak híg vizes oldatokban igaz. A pH valójában a hidrogénion-aktivitástól függ, ami töményebb oldatokban nem egyenlő a hidrogénion-koncentrációval. Tömény oldatok esetén a pH-t a hidrogénion-aktivitás segítségével fejezzük ki:
p H = − log 10 ( a H + ) {\displaystyle \mathrm {pH=-\log _{10}(a_{H^{+}})\!} }A képletben a H + {\displaystyle a_{\mathrm {H^{+}} }} a hidrogénion-aktivitás. A hidrogénion-aktivitást a koncentrációból az aktivitási együttható ( f {\displaystyle f\!} , vagy γ ± {\displaystyle \gamma _{\pm }} ) segítségével kaphatjuk meg. Az aktivitási együttható egy 0 és 1 közé eső viszonyszám, mely számos tényezőtől, köztük a hidrogénion-koncentrációtól függ.
a H + = f ⋅ {\displaystyle \mathrm {a} _{\mathrm {H^{+}} }=f\cdot \mathrm {} \!} p H = − log 10 ( f ⋅ ) {\displaystyle \mathrm {pH} =-\log _{10}(f\cdot \mathrm {} )\!}Kis hidrogénion-koncentráció mellett az aktivitási együttható magas, értéke jó közelítéssel 1. Így híg oldatban a hidrogénion-koncentráció megegyezik a hidrogénion-aktivitással. A pH tehát közvetlenül számolható a koncentrációból.
f = 1 {\displaystyle \mathrm {f} =1\!} p H = − log 10 ( f ⋅ ) = − log 10 ( 1 ⋅ ) {\displaystyle \mathrm {pH} =-\log _{10}(f\cdot \mathrm {} )=-\log _{10}(1\cdot \mathrm {} )\!} p H = − log 10 = − lg {\displaystyle \mathrm {pH} =-\log _{10}\mathrm {} =-\lg \mathrm {} \!}A pH mértékegységéről
A fenti képletek az ún. szabványos koncentráció mértékegységét tartalmazzák, amely az SI-egységnek ezredrésze: mol/dm³. Ebben további ellentmondás, hogy a koncentrációnál a nevezőben az egész oldat térfogata áll, míg a molalitásnál csak az oldószer tömege kerül a nevezőbe. A Green Book második kiadása egyenértékűként fogadta el kétféle mértékegységgel is (γ± az ionos aktivitási együttható az IUPAC dokumentumban; azonos a fent alkalmazott f jelű fizikai mennyiséggel) :
p H = − l g ± 0 , 02 {\displaystyle pH=-\mathrm {l} g\left\pm 0,02}
p H = − l g ± 0 , 02 {\displaystyle pH=-\mathrm {l} g\left\pm 0,02}
A törtvonal értelme e képletekben az, hogy a fizikai mennyiség értékét osztjuk a mértékegységével, így annak mérőszámát kapjuk. Aktuálisan ez azt jelentette, hogy a koncentráció és a molalitás mérőszáma azonos, máskülönben nem eredményezhetnének azonos pH-értéket. Ne felejtsük el azt sem, hogy a képletben nem a koncentráció SI-mértékegysége szerepel, hanem annak ezredrésze, aktuálisan: mol/dm³, ami sérti a mértékegységrendszer koherenciáját. A dokumentumok erre a problémára egy másik megoldást is adnak; definiálják a szabványos koncentráció fogalmát a következőképpen: c ⊖ = 1 m o l d m − 3 {\displaystyle c^{\ominus }=1\ \mathrm {mol\ dm^{-3}} }
A harmadik kiadás egyértelműen úgy határoz, hogy a hidrogénion-„koncentráció” mértékegységét a molalitás szabványos mértékegységében mért mérőszámból kell meghatározni. Ennek nagysága m ⊖ = 1 m o l / k g {\displaystyle m^{\ominus }=1\ \mathrm {mol/kg} } . (A vizes oldatok sűrűségének mérőszáma kg/dm³-ben az egyhez közeli érték.) Ebből következően a logaritmus függvény argumentuma 1 mértékegységű szám: m o l / k g m o l / k g = 1 {\displaystyle {\frac {\mathrm {mol/kg} }{\mathrm {mol/kg} }}=1} , így teljesül az a feltétel, hogy logaritmust csak dimenziómentes mérőszámból szabad számítani. A dokumentum kitér arra is, hogy a molalitás jeléül nem helyes az m betűt használni, mert összetéveszthető a tömeg jelével. Ezért javasolja inkább a b betű használatát.
A Green Book harmadik kiadása a következőképpen határozza meg a pH-t:
p H = − l g a H + = − l g m H + ⋅ γ m , H + m ⊖ {\displaystyle pH=-\mathrm {l} g\ a_{\mathrm {H} +}=-\mathrm {l} g\ {\frac {m_{\mathrm {H} +}\centerdot \gamma _{m,{\mathrm {H} +}}}{m^{\ominus }}}}
Története
A pH fogalmát Søren Peter Lauritz Sørensen (1868–1939) dán biokémikus vezette be, melyet ő még a vizes oldatbeli oxóniumion mol/dm³-ben kifejezett egyensúlyi koncentrációjával () definiált:
p H = − log 10 ( 1 m o l d m 3 ) . {\displaystyle \mathrm {pH=-\log _{10}\left({\frac {}{1{\frac {mol}{dm^{3}}}}}\right)} .\!}Szobahőmérsékleten (kb. 22 °C-on) 1 dm³ vegytiszta víz, autoprotolízisének köszönhetően dinamikus egyensúlyban 10−7 mol hidrogéniont (H+ vagy H3O+) és – értelemszerűen – ugyanennyi hidroxidiont (OH−) tartalmaz:
H 2 O + H 2 O ⇌ H 3 O + + O H − {\displaystyle \mathrm {H_{2}O+H_{2}O\rightleftharpoons H_{3}O^{+}+OH^{-}} \!} = = 10 − 7 m o l d m 3 {\displaystyle \mathrm {==10^{-7}{\frac {mol}{dm^{3}}}} \!} p H = − log 10 ( 10 − 7 m o l d m 3 1 m o l d m 3 ) = 7 {\displaystyle \mathrm {pH=-\log _{10}\left({\frac {10^{-7}{\frac {mol}{dm^{3}}}}{1{\frac {mol}{dm^{3}}}}}\right)=7} \!}Ekkor tehát Sørensen szerint a pH-értéke 7. Ez tekinthető a semleges kémhatásnak. Ennél kisebb pH-érték, vagyis a hidroxidionokhoz képest nagyobb hidrogénion koncentráció savasságot, nagyobb pH-érték pedig lúgosságot jelez.
Nem vizes oldatokban
A pH fogalma jellegéből adódóan más egyéb autoprotolízisre hajlamos kémiai rendszerekre is kiterjeszthető. Például a vegytiszta etanol (C2H5OH) szobahőmérsékleten és ugyancsak dinamikus egyensúlyban 10−10 mol protonált és ugyanennyi deprotonált molekulát tartalmaz dm³-enként. Ekkor a semleges kémhatáshoz tartozó pH-érték 10.
Jegyzetek
- ↑ Quantities, Units and Symbols in Physical Chemistry. IUPAC. RSC Publishing, 2007. . (Hozzáférés: 2017. május 19.)
- ↑ Biochemische Zeitschrift: 21 p131-200 1909.
Források
- Acids, Bases and pH (A City University of New York honlapján)
- Activities of hydrogen ion Archiválva 2008. április 24-i dátummal a Wayback Machine-ben (A Stetson University honlapján)
- Kémhatás, pH
- https://web.archive.org/web/20090228061714/http://celebrate.digitalbrain.com/celebrate/community/celebrate/resources/Hungary/kemia/A%20kemhatas/home/
- https://web.archive.org/web/20101224102826/http://www.sulinet.hu/tart/fncikk/Kidb/0/24833/index.html
- http://termtud.akg.hu/okt/7/viz/9kemhatas.htm
- http://termtud.akg.hu/okt/7/viz/9kemhatas.htm
- Online pH calculator
- Viz pH teszt, YouTube
Kapcsolódó szócikkek
| Nemzetközi katalógusok |
|---|





 a hidrogénion-aktivitás.
A hidrogénion-aktivitást a koncentrációból az
a hidrogénion-aktivitás.
A hidrogénion-aktivitást a koncentrációból az  , vagy
γ
±
{\displaystyle \gamma _{\pm }}
, vagy
γ
±
{\displaystyle \gamma _{\pm }}
 ) segítségével kaphatjuk meg. Az aktivitási együttható egy 0 és 1 közé eső viszonyszám, mely számos tényezőtől, köztük a hidrogénion-koncentrációtól függ.
) segítségével kaphatjuk meg. Az aktivitási együttható egy 0 és 1 közé eső viszonyszám, mely számos tényezőtől, köztük a hidrogénion-koncentrációtól függ.
 p
H
=
−
log
10
(
f
⋅
)
{\displaystyle \mathrm {pH} =-\log _{10}(f\cdot \mathrm {} )\!}
p
H
=
−
log
10
(
f
⋅
)
{\displaystyle \mathrm {pH} =-\log _{10}(f\cdot \mathrm {} )\!}

 p
H
=
−
log
10
(
f
⋅
)
=
−
log
10
(
1
⋅
)
{\displaystyle \mathrm {pH} =-\log _{10}(f\cdot \mathrm {} )=-\log _{10}(1\cdot \mathrm {} )\!}
p
H
=
−
log
10
(
f
⋅
)
=
−
log
10
(
1
⋅
)
{\displaystyle \mathrm {pH} =-\log _{10}(f\cdot \mathrm {} )=-\log _{10}(1\cdot \mathrm {} )\!}
 p
H
=
−
log
10
=
−
lg
{\displaystyle \mathrm {pH} =-\log _{10}\mathrm {} =-\lg \mathrm {} \!}
p
H
=
−
log
10
=
−
lg
{\displaystyle \mathrm {pH} =-\log _{10}\mathrm {} =-\lg \mathrm {} \!}



 . (A vizes oldatok sűrűségének mérőszáma kg/dm³-ben az egyhez közeli érték.) Ebből következően a logaritmus függvény argumentuma 1 mértékegységű szám:
m
o
l
/
k
g
m
o
l
/
k
g
=
1
{\displaystyle {\frac {\mathrm {mol/kg} }{\mathrm {mol/kg} }}=1}
. (A vizes oldatok sűrűségének mérőszáma kg/dm³-ben az egyhez közeli érték.) Ebből következően a logaritmus függvény argumentuma 1 mértékegységű szám:
m
o
l
/
k
g
m
o
l
/
k
g
=
1
{\displaystyle {\frac {\mathrm {mol/kg} }{\mathrm {mol/kg} }}=1}
 , így teljesül az a feltétel, hogy logaritmust csak dimenziómentes mérőszámból szabad számítani. A dokumentum kitér arra is, hogy a molalitás jeléül nem helyes az m betűt használni, mert összetéveszthető a tömeg jelével. Ezért javasolja inkább a b betű használatát.
, így teljesül az a feltétel, hogy logaritmust csak dimenziómentes mérőszámból szabad számítani. A dokumentum kitér arra is, hogy a molalitás jeléül nem helyes az m betűt használni, mert összetéveszthető a tömeg jelével. Ezért javasolja inkább a b betű használatát.


 =
=
10
−
7
m
o
l
d
m
3
{\displaystyle \mathrm {==10^{-7}{\frac {mol}{dm^{3}}}} \!}
=
=
10
−
7
m
o
l
d
m
3
{\displaystyle \mathrm {==10^{-7}{\frac {mol}{dm^{3}}}} \!}
 p
H
=
−
log
10
(
10
−
7
m
o
l
d
m
3
1
m
o
l
d
m
3
)
=
7
{\displaystyle \mathrm {pH=-\log _{10}\left({\frac {10^{-7}{\frac {mol}{dm^{3}}}}{1{\frac {mol}{dm^{3}}}}}\right)=7} \!}
p
H
=
−
log
10
(
10
−
7
m
o
l
d
m
3
1
m
o
l
d
m
3
)
=
7
{\displaystyle \mathrm {pH=-\log _{10}\left({\frac {10^{-7}{\frac {mol}{dm^{3}}}}{1{\frac {mol}{dm^{3}}}}}\right)=7} \!}
