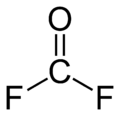
Karbonil-fluorid
Mai cikkünkben a Karbonil-fluorid lenyűgöző világát fedezzük fel. Történelmi eredetétől napjaink relevanciájáig, többféle felhasználásán és alkalmazásán keresztül, ennek a cikknek a célja, hogy teljes és részletes áttekintést nyújtson a Karbonil-fluorid-ről. A következő néhány sorban elemezzük a különböző területekre gyakorolt hatását, valamint a jelenlegi trendeket és kihívásokat. Multidiszciplináris megközelítéssel és kritikai perspektívával elmerülünk a Karbonil-fluorid összetettségében és sokszínűségében, hogy tájékozott és gazdagító perspektívát kínáljunk olvasóinknak erről az izgalmas témáról.
| Karbonil-fluorid | |||
| |||
| IUPAC-név | karbonil-difluorid | ||
| Más nevek | fluorfoszgén szén-difluorid-oxid | ||
| Kémiai azonosítók | |||
|---|---|---|---|
| CAS-szám | 353-50-4 | ||
| PubChem | 9623 | ||
| ChemSpider | 9246 | ||
| EINECS-szám | 206-534-2 | ||
| RTECS szám | FG6125000 | ||
| SMILES | FC(F)=O | ||
| InChI | 1/CF2O/c2-1(3)4 | ||
| InChIKey | IYRWEQXVUNLMAY-UHFFFAOYSA-N | ||
| UNII | 2NU89R5398 | ||
| UN-szám | 2417 | ||
| Kémiai és fizikai tulajdonságok | |||
| Kémiai képlet | COF2 | ||
| Moláris tömeg | 66,01 g mol−1 | ||
| Megjelenés | színtelen gáz | ||
| Sűrűség | 2,698 g dm−3 (gáz) | ||
| Olvadáspont | −111,26 °C | ||
| Forráspont | −84,57 °C | ||
| Oldhatóság (vízben) | hidrolízis[1] | ||
| Kristályszerkezet | |||
| Molekulaforma | C2v | ||
| Dipólusmomentum | 0,95 D | ||
| Veszélyek | |||
| MSDS | ICSC 0633 | ||
| EU osztályozás | Mérgező (T) Maró (C)[1] | ||
| Főbb veszélyek | erősen mérgező | ||
| NFPA 704 | |||
| R mondatok | R23, R35[1] | ||
| S mondatok | S9, S26, S36/37/39, S45[1] | ||
| Lobbanáspont | nem gyúlékony | ||
| Rokon vegyületek | |||
| Rokon vegyületek | foszgén | ||
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |||
A karbonil-fluorid a COF2 összetételű kémiai vegyület. Klóranalógjához, a foszgénhez hasonlóan erősen mérgező gáz. Molekulája síkszerkezetű, C2v szimmetriájú.
Tulajdonságai
Mérgező, szúrós szagú gáz, higroszkópossága miatt levegőn füstölög. Szerves oldószerekben (például benzolban, toluolban, klórbenzolban) jól oldódik. Vízben oldva gyorsan szén-dioxidra és hidrogén-fluoridra bomlik:
Előállítása
Többnyire a fluorozott szénhidrogének – például trifluormetanol vagy tetrafluormetán – hőbomlása során keletkezik, ha víz is van jelen:
Előállítható szén-monoxid és fluor reakciójával is:[2]
Biztonságtechnika
Rövid idejű munkavégzés esetén megengedett koncentrációja 2 ppm. Víz jelenlétében nem stabil vegyület.
Fordítás
Ez a szócikk részben vagy egészben a Carbonyl fluoride című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként. Ez a szócikk részben vagy egészben a Carbonylfluorid című német Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.